YANAGITA GROUP 柳田グループ

- HOME
- YANAGITA GROUP
柳田グループ
グループリーダー:柳田 素子(教授)
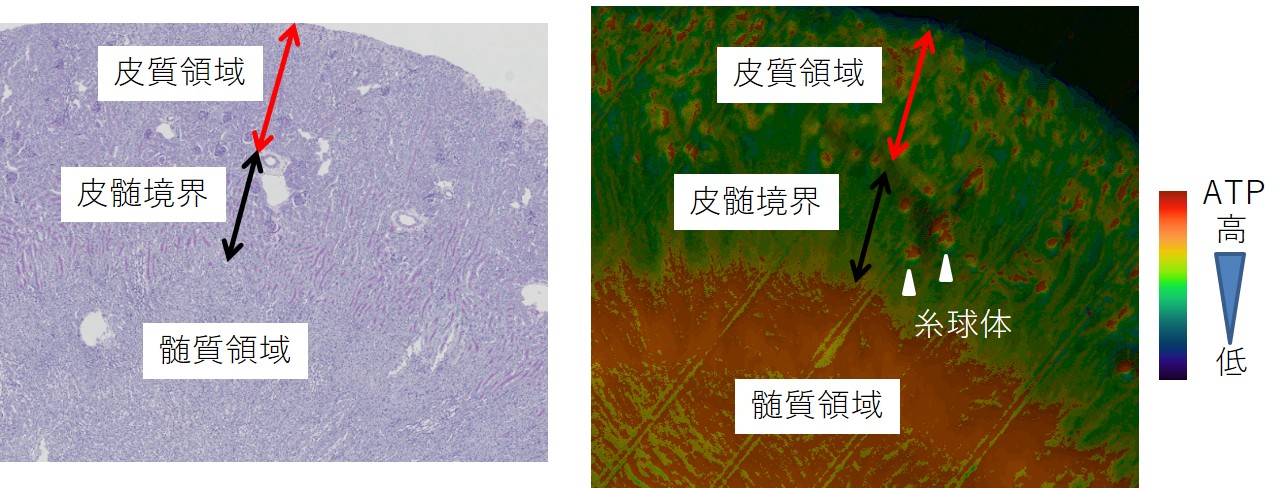
腎臓は原尿中の糖やアミノ酸、脂肪酸などを再吸収するために恒常的に多量のATPを消費するエネルギー代謝臓器です。近年マウスモデルにおいて、急性腎障害(Acute kidney injury: AKI)や糖尿病性腎臓病の発症により腎臓のエネルギー代謝プロファイルが変化するという知見が集積しており、エネルギー代謝と腎障害とが密接に関わっていることが明らかになってきました。私たちは次の課題として、エネルギー代謝の側面から、AKIから慢性腎臓病(Chronic kidney disease: CKD)に至る新たなメカニズムを解明したいと考えました。しかしながら、生体腎における各細胞のエネルギー代謝変化をリアルタイムに知ることはこれまでは技術的に困難でした。 そこで私たちはフェルスター共鳴エネルギー移動(FRET)バイオセンサーを全身発現させたATP 可視化マウスと二光子顕微鏡を用いることで、生体腎のATPダイナミズムを捉えることに成功しました。この結果、ネフロンセグメント(腎臓の機能部位)ごとの局在情報を含むダイナミックなATP量の変動解析が、高い画像解像度で可能となりました。まず、急性腎障害モデルである腎動脈の虚血再灌流障害を用いて、AKI時におけるネフロンセグメント毎のATP動態を解析しました(図1)。虚血性AKIでは、近位尿細管ではATPが低下しやすい一方、遠位尿細管ではATPの保持が優れており、その挙動が全く異なることを示しました。さらに、近位尿細管のATP回復率は、腎予後と相関しており、エネルギー代謝の恒常性破綻がAKIからの回復、非回復と密接に関連することを明らかにしました。また、低温条件下の虚血性AKIでは、ATP回復が著明に改善することを証明し、低温療法の有効性を確認しました(Yamamoto Shinya, Yanagita M, et al., J Am Soc Nephrol 2020. PMID: 33046532)。 図1. 虚血再灌流障害における再灌流時のATP回復 次に糸球体におけるATPの観察に成功しました(図2)。アルブミン尿は糸球体濾過バリアの破綻を示唆し、AKI後のアルブミン尿は腎予後不良と関連することが示唆されております。私たちは濾過バリアの形成に重要なポドサイトにおける虚血性AKI後のATP回復不良と慢性期障害が関連すること、過剰なミトコンドリア分裂を抑制することが治療手段となりうることを示しました(Takahashi M, Yanagita M, et al., Nat Commun 2024. PMID: 39578451)。また更に深部のネフロンセグメントの観察を行うために、同マウスの腎スライス切片を作成し、生体内に近いATP産生が保たれる培養条件を確立しました(図3)。本系を用いて全ネフロン領域のATP動態の可視化を実現し、また生体では評価が困難であった各セグメントのATP産生における酸化的リン酸化、解糖系への依存度の違いを示しました。このスライス培養下での虚血再灌流障害を模した系におけるATP動態と組織学的変化は生体を用いた研究の結果と類似し、虚血再灌流障害の病態をよく再現していることが確認されました。またシスプラチン腎症を模倣した系においては、近位尿細管や遠位尿細管における疾患脆弱性を明らかにしました。本培養系は、腎臓の三次元構造を保持し、一つの腎臓から複数のスライス切片を作成できるため動物愛護の観点からも適しており、病態腎における代謝変化の解明や、腎毒性薬剤のスクリーニング、ミトコンドリア保護薬をはじめとした創薬開発にも有効な実験手法を提供したと考えます(Yamamoto Shigenori, Yanagita M et al. Kidney Int 2024. PMID: 38996810)。 現在、薬剤性腎症、ネフローゼ症候群モデル、糖尿病モデル、老化モデルなどの様々な腎障害モデルにおけるATP動態を解析しています。本研究は、腎臓におけるエネルギー代謝のダイナミズムを解析するブレークスルーとなり、腎臓の恒常性維持および障害・修復のメカニズムを全く新しい切り口から再考することを可能にします。このメカニズムの解明が、AKI からCKD への進展を防ぐ治療開発に繋がることを期待しています。 講師 山本 伸也 先進国を中心に血液透析や腎移植を必要とする末期腎不全患者が増加の一途を辿っており、その対策が医療的・社会的に大きな課題になっております。高齢者はAKI後に腎修復が十分に起こらず、CKDや末期腎不全に移行する頻度が高いことが知られていますが、そのメカニズムには不明点が多く残されていました。私たちは、高齢マウスでは腎障害後に三次リンパ組織(Tertiary lymphoid tissue: TLT)という異所性のリンパ組織が形成され、これが炎症を持続させることが組織修復不全の一因である可能性を見出しました(図4)(Sato Y, Yanagita M et al. JCI insight 2016. PMID: 27699223)。TLTは少なくとも3つの異なる段階を経て発生・成熟すること、この過程において特殊な形質を獲得した腎線維芽細胞が重要な役割を担うことも見出しました。加齢に伴うTLT形成はヒトにおいても確認され、TLTの構成成分がヒトとマウスで極めて類似していることから、本現象は種を超えて保存された現象であると考えられます。
1 新規組織障害マーカーとしての三次リンパ組織
3 三次リンパ組織内部は周囲の近位尿細管の修復を妨げ、また、近位尿細管や線維芽細胞の向炎症形質を増強し、腎臓の炎症を増幅する
4 腎臓以外の他臓器における三次リンパ組織の解析と臨床的意義の解明; 三次リンパ組織は高齢マウスやC型肝炎患者さんの肝臓にも形成され、肝線維化に関わる 特定病院助教 好川 貴久 腎臓は血流が豊富であり虚血に対して脆弱であること、代謝が盛んであって様々な薬剤により障害を受けやすいことなど臓器障害をきたしやすい一方で、障害を受けると修復されにくく、感受性には性差があると考えられてきました。 そこで我々の研究室ではこれまでに、急性腎障害に対する腎臓の応答性について研究を進めてきました。中でも、急性腎障害に対し最も脆弱であると考えられている近位尿細管が、腎障害後に自己修復すること、その一方で修復能が限定的であり短縮してしまうことを示しました(Endo T, Yanagita M, et al. J Pathol 2015. PMID: 25664690)。 また、近位尿細管上皮細胞のみに細胞死を誘導できる遺伝子改変マウスを用いることで、近位尿細管単独の障害が急性腎障害を惹起し、周囲の線維化ならびに腎性貧血につながること、さらには糸球体硬化や遠位尿細管障害などネフロン内の様々なsegmentに障害が波及することを示しました(Takaori K, Yanagita M, et al. J Am Soc Nephrol 2016. PMID: 26701981)。また近位尿細管障害の強さと頻度が慢性腎臓病への進展に寄与することが明らかになりました。 これらの所見は成人期の腎障害を想定しておりますが、一方で慢性腎臓病を有する小児の患者さんでは性成熟期(思春期)に腎疾患の進行が加速する現象が知られておりました。その機序を明らかにするために、マウスに性成熟前後で卵巣摘出術を行い腎障害に対する近位尿細管の脆弱性を評価したところ、性成熟後だと脆弱性が高まるのに対し性成熟前だと抵抗性が高まること、女性ホルモンであるエストロゲンの作用には2面性があることを見出しました(Kitai Y, Yanagita M, et al. Kidney Int 2024. PMID: 39503698)。 さらに、腎臓には尿細管だけでなく、間質と呼ばれる領域に低酸素に応答して造血を促すエリスロポエチンを産生する線維芽細胞が存在しており、腎不全とともに腎性貧血と呼ばれるエリスロポエチン産生能の低下をきたすことが知られております。我々はエリスロポエチン産生細胞を追跡できるマウスを作成し、腎線維芽細胞のうちエリスロポエチン産生能を有する細胞は限られた亜集団であり、腎障害に伴い一度エリスロポエチン産生能を失っても腎障害から回復すると再度産生能を獲得することが明らかになりました(Kaneko K, Yanagita M, et al. Kidney Int 2022. PMID: 35644281) これらの知見を参考に、現在我々は腎障害とその後の修復に注目し自己修復を妨げている亜集団が存在するのではないかと考え細胞レベルでの評価を行っております。腎障害後には多くの細胞が組織修復の過程で細胞周期進入をきたし、大半が正常の修復過程をたどりますが、中には炎症性形質の強い細胞集団が出現することが近年わかってきました。我々は、この細胞集団の性質から細胞老化との関連について検討を行っています。細胞老化とは、①恒常的な細胞周期停止、②細胞内小器官における代謝異常、③炎症関連物質の分泌を特徴とした培養細胞で定義された細胞の状態を指しますが、近年生体内でも蓄積し臓器障害に寄与する可能性が示唆されています。ただし老化細胞は様々な状況により誘導され、また細胞の種類によっても様々な形質を呈することから特異的なマーカーが存在しないため、生体内での可視化が容易ではないと考えられております。 そこで我々の研究室では、老化細胞が腎臓の微小環境においてどのような挙動をするか、また周囲の細胞に対しどのような影響を与えるかについて遺伝子改変マウスを用いて評価しております。今後腎臓病と老化細胞の関係について詳細な評価を進めていくことでヒトの腎臓病の病態理解のみならず新規治療法開発につながるものと期待しています。 特定助教 山田 龍
グループメンバー:
留学中;佐藤 有紀(米国Mayo clinic)
講師;山本 伸也
特定病院助教;好川 貴久
特定助教(生体環境応答学講座);山田 龍
ASHBi 特定研究員;鳥生 直哉、岩重 洋平
特定研究員;谷口 圭祐
客員研究員;萩原 広一郎(本務、西神戸医療センター)
大学院生・研究生;荒井 宏之、大久保 明紘、上松瀬 良、後藤 志麻(創薬医学講座 成宮研)、森西 卓也、池田 紘幸、小西 諒、杤尾 明、森田 圭介、倉橋 聡司、小阪 健祥、松本 みなみ
出向中;中村 和史(分子生体統御学講座医化学分野 竹内研)、孫 楽(理研・ASHBi)、森田 元(免疫細胞生物学)、森 雄一郎(人間健康科学 福間研)、髙柳 俊亮、東 良亮(人間健康科学 奥野研)、石田 万菜(人間健康科学 奥野研)
技術補佐員;石崎 千尋、齋藤 まどか、藤木 美佐子
(旧) 横井グループ:
研究生;石村 拓也、井上 唯衣、岩木 亮介
技術補佐員;鈴木 遥
秘書;水上 由紀
研究チームのご紹介:
Imagingチーム
TLTチーム
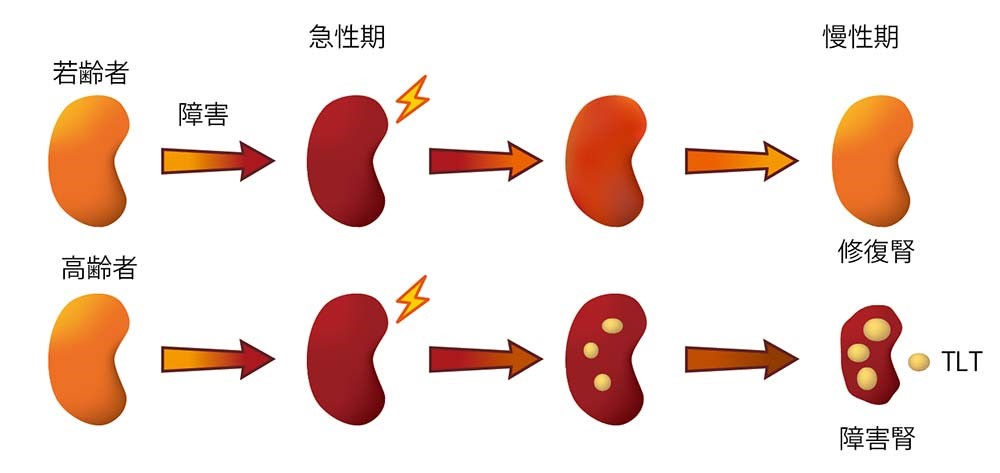
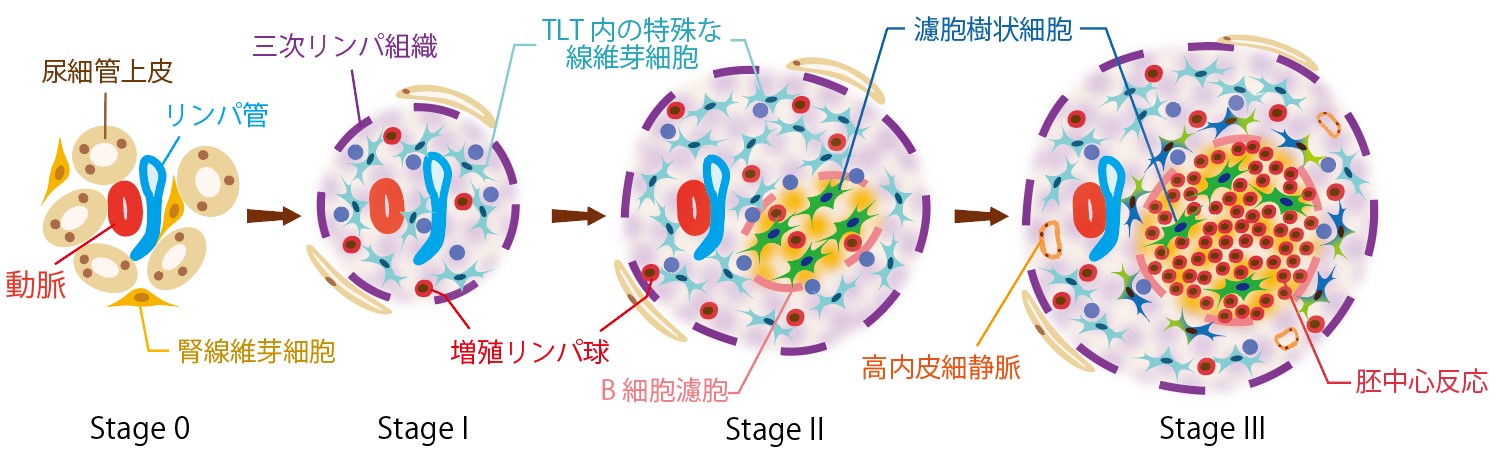
高齢個体の腎臓病以外にも、これまで様々なCKDでTLT形成が報告されておりましたが、TLTの評価系が存在しなかったことからその臨床的意義は不明でした。私たちはTLTが異なる3つの段階を経て成熟することに着目し、障害が重篤である程TLTの成熟が進行することを見出し、この知見を基に成熟度でTLTを分類する組織分類(stage分類)を確立しTLTの客観的な評価系として提唱しました(図5)(Sato Y, Yanagita M et al. Kidney Int 2020. PMID: 32473779)。さらに本stage分類を用いて、私たちは秋田大学との共同研究で、腎移植後、拒絶のないプロトコール生検腎組織におけるTLTの有無と腎予後について検討を行い、移植後12ヵ月後に成熟したTLTが腎臓に誘導されている症例では、他の症例に比較して移植後の腎機能が低下しやすいことを報告しました(図6)(Lee YH, Sato Y, Yanagita M et al. J Am Soc Nephrol 2022. PMID: 34725107)。本知見はTLTが拒絶のない移植腎における腎予後不良因子であるということを示した初めての報告となりました。本文類を用いて各種腎疾患におけるTLTの解析を行うことによりTLTの臨床的意義を明らかにすることで各種腎疾患の新規治療戦略の開発に繋がる可能性があります。

2 三次リンパ組織は加齢に伴い出現するユニークな2種類のリンパ球の相互作用で誘導される
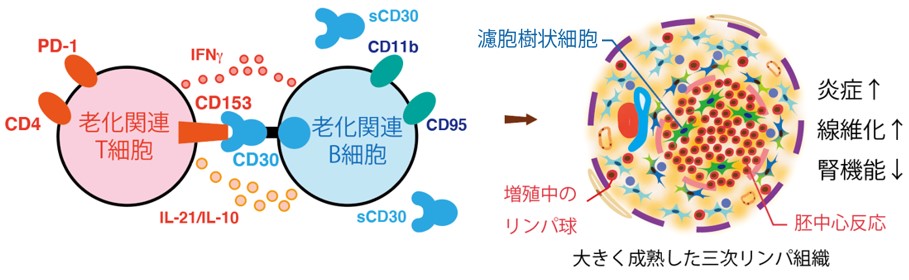
私たちは腎TLT形成の分子メカニズムを解明する目的でTLTを構成する免疫細胞の網羅的な解析を行い、若齢では殆ど存在せず加齢に伴い出現する2種類の特殊なリンパ球、老化関連T細胞(Senescence-associated T cell: SAT)と老化関連B細胞(Age-associated B cell: ABC)が、TLT内部に蓄積することを見出しました。さらに両者はCD153-CD30という分子を介して相互作用し、互いを活性化することでTLTの拡大を促進していることを報告しました(図7)。高齢CD153遺伝子欠損マウスの腎障害モデルではTLTの形成不全を呈し、併せて腎機能障害や線維化の軽減も認められました。CD153-CD30はヒト自己免疫疾患でSATやABCと同等の機能を有する細胞でも発現が確認されており、高齢者腎臓病の新規治療標的分子として今後の更なる研究発展が期待されます(Sato Y, Yanagita M et al. J Clin Invest 2022. PMID: 34813503)。
三次リンパ組織は多様な免疫細胞と線維芽細胞の骨格から成り、その周囲には尿細管上皮が取り囲むように存在います。これらの細胞がどのような形質をもち、どのような細胞間相互作用を持つか、ということの理解は腎三次リンパ組織の病態形成機序の解明に必要不可欠です。私たちは高齢マウスの障害腎を1核網羅的遺伝子発現解析(single-nucleus RNA-sequencing)という手法を用いて解析し、その多様な細胞種について解析をしました。その結果、三次リンパ組織周囲には向炎症形質を獲得した修復不全近位尿細管が高頻度に存在し、それら上皮が周囲の血球とも相互作用を持ち、炎症を増幅させること、また、三次リンパ組織内部の線維芽細胞の向炎症形質がT細胞との相互作用により増強され、三次リンパ組織の拡大に寄与していることを見出し、報告しました(Yoshikawa T, Yanagita M, et al. J Am Soc Nephrol 2023. PMID: 37548710)。本研究は三次リンパ組織が周囲の尿細管上皮の修復を阻害しうるという腎障害機序について初めて示したものになり、これらの相互作用で同定されたシグナル経路は高齢腎障害の治療対象としても期待されます。
三次リンパ組織は腎臓のみならず、肝臓、肺、唾液腺など多様な臓器に形成されることが報告されています。私たちは肝臓について解析を行い、高齢マウスやC型肝炎患者さんの肝臓においても、三次リンパ組織が形成されること、肝臓の三次リンパ組織も、腎臓の三次リンパ組織と同様にリンパ球と特殊な線維芽細胞で形成され、老化関連T細胞と老化関連B細胞が三次リンパ組織内部に蓄積していることを示しました。さらに肝臓に三次リンパ組織が認められるC型肝炎患者さんは肝線維化が亢進している傾向があることを明らかにしました(Toriu N, Yanagita M, et al. PLoS One 2025. PMID: 40014629)。三次リンパ組織は多臓器横断的に共通した病態であり、三次リンパ組織の研究は幅広く応用される可能性があります。
細胞老化・周期チーム
柳田研究室のこれまでの業績(論文集)
“Tertiary lymphoid structures: chronic inflammatory microenvironments in kidney diseases”
Int Immunol. 2025 Mar 24:dxaf017.
(65)Ryo Yamada, Motoko Yanagita.
“When two signals cross paths: cGAS-STING and ER stress in kidney disease progression”
Kidney Int. 2025 Feb;107(2):227-229.
(64)Naoya Toriu, Yuki Sato, Hiroteru Kamimura, Takahisa Yoshikawa, Masaou Tanaka, Shinya Yamamoto, Shingo Fukuma, Masakazu Hattori, Shuji Terai, Motoko Yanagita.
“Aligning cellular and molecular components in age-dependent tertiary lymphoid tissues of kidney and liver”
PLoS One. 2025 Feb 27;20(2):e0311193.
(63) Takahisa Yoshikawa, Motoko Yanagita.
“Single-Cell Analysis Provides New Insights into the Roles of Tertiary Lymphoid Structures and Immune Cell Infiltration in Kidney Injury and Chronic Kidney Disease”
Am J Pathol. 2025 Jan;195(1):40-54.
(62) Yuichiro Kitai, Naoya Toriu, Takahisa Yoshikawa, Yoshiki Sahara, Sonoko Kinjo, Yoko Shimizu, Yuki Sato, Akiko Oguchi, Ryo Yamada, Makiko Kondo, Eiichiro Uchino, Keisuke Taniguchi, Hiroyuki Arai, Takayoshi Sasako, Hironori Haga, Shingo Fukuma, Naoto Kubota, Takashi Kadowaki, Minoru Takasato, Yasuhiro Murakawa, Motoko Yanagita.
“Female sex hormones inversely regulate acute kidney disease susceptibility throughout life”
Kidney Int. 2025 Jan;107(1):68-83.
press release
(61) Naoya Toriu, Shinya Yamamoto, Takeshi Matsubara, Yuki Kataoka, Kaoru Sakai, Taro Funakoshi, Takahiro Horimatsu, Tatsuo Tsukamoto, Naoka Murakami, Kenar D Jhaveri, Shingo Fukuma, Tomohiro Terada, Manabu Muto, Shunichi Fukuhara, Motoko Yanagita; Onconephrology Consortium in Japan.
“Cancer diagnosis and prognosis after initiation of hemodialysis: multicenter Japan CANcer and DialYsis (J-CANDY) study”
Clin Kidney J. 2024 Dec 20;18(2):sfae430.
press release
(60) Masahiro Takahashi, Shinya Yamamoto, Shigenori Yamamoto, Akihiro Okubo, Yasuaki Nakagawa, Koichiro Kuwahara, Taiji Matsusaka, Shingo Fukuma, Masamichi Yamamoto, Michiyuki Matsuda, Motoko Yanagita.
“ATP dynamics as a predictor of future podocyte structure and function after acute ischemic kidney injury in female mice”
Nat Commun. 2024 Nov 22;15(1):9977.
press release
(59)Shigenori Yamamoto, Shinya Yamamoto, Masahiro Takahashi, Akiko Mii, Akihiro Okubo, Naoya Toriu, Shunsaku Nakagawa, Takaaki Abe, Shingo Fukuma, Hiromi Imamura, Masamichi Yamamoto, Motoko Yanagita.
“Visualization of intracellular ATP dynamics in different nephron segments under pathophysiological conditions using the kidney slice culture system”
Kidney Int . 2024 Sep;106(3):470-481.
press release
(58)Yasumichi Arai, Motoko Yanagita.
“Healthy ageing and the kidney – lessons from centenarians”
Nat Rev Nephrol. 2024 Sep;20(9):558-559.
(57) Keiko Yano-Sakamoto, Yuichiro Kitai, Naoya Toriu, Shinya Yamamoto, Ken Mizuta, Mitinori Saitou, Tomoyuki Tsukiyama, Ichiro Taniuchi, Motomi Osato, Motoko Yanagita.
“Expression pattern of Runt-related transcription factor (RUNX) family members and the role of RUNX1 during kidney development”
Biochem Biophys Res Commun. 2024 Aug 30;722:150-155.
(56)Takahisa Yoshikawa, Akiko Oguchi, Naoya Toriu, Yuki Sato, Takashi Kobayashi, Osamu Ogawa, Hironori Haga, Satoko Sakurai, Takuya Yamamoto, Yasuhiro Murakawa, Motoko Yanagita.
“Tertiary Lymphoid Tissues Are Microenvironments with Intensive Interactions between Immune Cells and Proinflammatory Parenchymal Cells in Aged Kidneys”
J Am Soc Nephrol . 2023 Oct 1;34(10):1687-1708.
(55)Yuki Sato, Karina Silina, Maries van den Broek, Kiyoshi Hirahara, Motoko Yanagita.
“The roles of tertiary lymphoid structures in chronic diseases”
Nat Rev Nephrol. 2023 Aug;19(8):525-537.
(54)Yuki Ariyasu, Yuki Sato, Yosuke Isobe, Keisuke Taniguchi, Motoko Yanagita, Makoto Arita.
“Sterol O-Acyltransferase Inhibition Ameliorates High-Fat Diet-Induced Renal Fibrosis and Tertiary Lymphoid Tissue Maturation after Ischemic Reperfusion Injury”
Int J Mol Sci. 2022 Dec 7;23(24):15465.
(53)Takahisa Yoshikawa, Yu Ho Lee, Yuki Sato, Motoko Yanagita.
“Tertiary lymphoid tissues in kidney diseases: a perspective for the pediatric nephrologist”
Pediatr Nephrol. 2022 Oct 17.https://doi.org/10.1007/s00467-022-05770-4
(52)Keiichi Kaneko, Yuki Sato, EiichiroUchino, Naoya Toriu, Mayo Shigeta, Hiroshi Kiyonari, Shuichiro Endo, Sshingo Fukuma, Motoko Yanagita.
“Lineage tracing analysis defines erythropoietin-producing cells as a distinct subpopulation of resident fibroblasts with unique behaviors”
Kidney Int. 102(2):280-292.
(51)Yuki Sato, Yu Ho Lee, Keisuke Taniguchi, Takahisa Yoshikawa, Peter Boor, Jürgen Floege, Motoko Yanagita.
“Author’s reply. Advanced tertiary lymphoid tissues in protocol biopsies in kidney transplant recipients: Addressing additional methods to detect intragraft B cells”
J Am Soc Nephrol. 33(4):868-869.
(50)Hiroyuki Yamada, Motoko Yanagita.
”Global Perspectives in Acute Kidney Injury: Japan”
Kidney360. 2022 Mar 29;3(6):1099-1104.
(49)Yuki Sato, Akiko Oguchi, Yuji Fukushima, Kyoko Masuda, Naoya Toriu, Keisuke Taniguchi, Takahisa Yoshikawa, Xiaotong Cui, Makiko Kondo, Takeshi Hosoi, Shota Komidori, Yoko Shimizu, Harumi Fujita, Li Jiang, Yingvi Kong, Takashi Yamanashi, Jun Seita, Takuya Yamamoto, Shinya Toyokuni, Yoko Hamazaki, Masakazu Hattori, Yasunobu Yoshikai, Peter Boor, Jürgen Floege, Hiroshi Kawamoto, Yasuhiro Murakawa, Nagahiro Minato, Motoko Yanagita.
“CD153-CD30 signaling promotes age-dependent tertiary lymphoid tissue expansion and kidney injury”
J Clin Invest. 2022;132(2):e146071.
(48)Yamamoto S, Motoko Yanagita.
”A Novel Pathological Mechanism of Tertiary Lymphoid Structure Formation in the Renal Pelvis.”
J Am Soc Nephrol. 2022 Jan;33(1):4-6.
(47)Yu Ho Lee*, Yuki Sato*, Mitsuru Saito, Shingo Fukuma, Masaya Saito, Shigenori Yamamoto, Atsushi Komatsuda, Nobuhiro Fujiyama, Shigeru Satoh, Sang-Ho Lee, Peter Boor, Tomonori Habuchi, Jürgen Floege, Motoko Yanagita.
“Advanced tertiary lymphoid tissues in protocol biopsies are associated with progressive graft dysfunction in kidney transplant recipients.”
J Am Soc Nephrol. 2022, 33,186-200. (*: equally co-first author)
(46)Yamada R, Motoko Yanagita.
“Unexpected cause of vemurafenib-induced nephrotoxicity: ferrochelatase”
Kidney Int. 2021 Dec;100(6):1158-1160.
(45)Yuki Sato, Masaru Tamura, Motoko Yanagita.
“Tertiary lymphoid tissues: a regional hub for kidney inflammation”
Nephrol Dial Transplant. 2021;37:1-8.
(44)Hiroyuki Arai, Yuki Sato, Motoko Yanagita.
“Fibroblast heterogeneity and tertiary lymphoid tissues in the kidney”
Immunol Rev. 2021. PMID: 33951198.
(43)Yuichiro Kitai , Masaomi Nangaku , Motoko Yanagita.
“Aging-Related Kidney Diseases.”
Contrib Nephrol. 2021;199:266-273.
(42)Shinya Yamamoto, Masamichi Yamamoto, Jin Nakamura, Akiko Mii, Shigenori Yamamoto, Masahiro Takahashi, Keiichi Kaneko, Yuki Sato, Shingo Fukuma, Hiromi Imamura, Michiyuki Matsuda, Motoko Yanagita.
“Spatiotemporal ATP dynamics during acute kidney injury predicts renal prognosis”
J Am Soc Nephrol. 2020, 31(12) 2855-2869.
(41)Yuki Sato, Peter Boor, Shingo Fukuma, Barbara M. Klinkhammer, Hironori Haga, Osamu Ogawa, Jürgen Floege, Motoko Yanagita.
“Developmental stages of tertiary lymphoid tissue reflect local injury and inflammation in murine and human kidneys”
Kidney Int. 2020, 98(2),448-463.
(40)Hiroyuki Arai, Motoko Yanagita.
”Janus-Faced: Molecular Mechanisms and Versatile Nature of Renal Fibrosis”
Kidney360. July 2020, 1 (7) 697-704.
(39)Yuki Sato*, Masahiro Takahashi*, Motoko Yanagita.
“Pathophysiology of AKI to CKD progression”
Semin Nephrol. 2020;40(2):206-215. (*: equally co-first author)
(38)Yuki Sato, Motoko Yanagita.
“The immunology of aging kidney”
Nat Rev Nephrol. 15, 625-640, 2019.
(37)Yuki Sato, Motoko Yanagita.
“Functional heterogeneity of resident fibroblasts in the kidney”
Proc Jpn Acad Ser B Phys Biol Sci. 2019;95(8):468-478.
(36)Yuki Sato, Motoko Yanagita.
“Unprecedented era of aging”
Inflammation and Regeneration. 39:15 2019.
(35)Jin Nakamura*, Yuki Sato*, Yuichiro Kitai*, Shuichi Wajima, Shinya Yamamoto, Akiko Oguchi, Ryo Yamada, Keiichi Kaneko, Makiko Kondo, Eiichiro Uchino, Junichi Tsuchida, Keita Hirano, Kumar Sharma, Kenji Kohno, Motoko Yanagita.
“Myofibroblasts acquire retinoic acid-producing ability during fibroblast-to-myofibroblast transition in kidney disease”
Kidney Int. 2019 95(3):526-539. (*: equally co-first author)
(34)Yuki Sato, Motoko Yanagita.
“Immune cells and inflammation in AKI to CKD progression”
Am J Physiol Renal Physiol. 2018 Dec 1;315(6):F1501-F1512.
(33)Taku Iguchi, Koji Takaori, Akiko Mii, Yuki Sato, Yasunori Suzuki, Hajime Yoshifuji, Hiroshi Seno, Osamu Ogawa, Koichi Omori, Kazuhisa Bessho, Satoru Kondo, Tomokazu Yoshizaki, Hitoshi Nakashima, Takao Saito, Tsuneyo Mimori, Hironori Haga, Mitsuhiro Kawano, Motoko Yanagita.
“Glucocorticoid receptor expression in resident and hematopoietic cells in IgG4-related disease”
Mod Pathol. 2018 Jun;31(6):890-899. doi: 10.1038/s41379-018-0036-4. Epub 2018 Feb 12.
(32)Yuki Sato, Motoko Yanagita.
“Resident fibroblasts in the kidney: a major driver of fibrosis and inflammation”
Inflamm Regen. 2017 Aug 7;37:17. Doi: 10. 1186/s41232-017-0048-3. eCollection 2017. Review. PMID: 29259716
(31)Mitchell H Rosner, Amaka Edeani, Motoko Yanagita, Ilya G. Glezerman, Nelson Leung for the American Society of Nephrology Onco-Nephrology Forum.
“Paraprotein-related Kidney Disease: More Than Monoclonal Gammopathy of Undetermined Significance- Diagnosing And Treating The Entity Monoclonal Gammopathy of Renal Significance For The Nephrologist”
Clin J Am Soc Nephrol. 2016 Dec 7;11(12):2280-2287. Epub 2016 Aug 15. DOI:10.2215/CJN.02920316
(30)Yuki Sato, Akiko Mii, Yoko Hamazaki, Harumi Fujita, Hirosuke Nakata, Kyoko Masuda, Shingo Nishiyama, Shinsuke Shibuya, Hironori Haga, Osamu Ogawa, Akira Shimizu, Shuh Narumiya, Tsuneyasu Kaisho, Makoto Arita, Masashi Yanagisawa, Masayuki Miyasaka, Kumar Sharma, Nagahiro Minato, Hiroshi Kawamoto, Motoko Yanagita.
“Heterogeneous fibroblasts underlie age-dependent tertiary lymphoid tissues in the kidney”
JCI Insight.2016 Jul 21; 1(11):e87680. DOI:10.1172/jci.insight.87680
(29)Koji Takaori, Motoko Yanagita.
“Insights into the Mechanisms of the Acute Kidney Injury-to-Chronic Kidney Disease Continuum”
Nephron. 2016;134(3):172-176. Epub 2016 Jul 12.
(28)Koji Takaori, Jin Nakamura, Shinya Yamamoto, Hirosuke Nakata, Yuki Sato, Masayuki Takase, Masaaki Nameta, Tadashi Yamamoto, Aris N. Economides, Kenji Kohno, Hironori Haga, Kumar Sharma, Motoko Yanagita.
“Severity and frequency of proximal tubule injury determines renal prognosis”
J Am Soc Nephrol. 2016 Aug;27(8):2393-406. doi: 10.1681/ASN.2015060647. Epub 2015 Dec 23.
(27)Yuichiro Kitai, Takeshi Matsubara, and Motoko Yanagita.
“Onco-nephrology: current concepts and future perspectives”
Jpn J Clin Oncol. 2015 Jul;45(7):617-28. doi: 10.1093/jjco/hyv035. Epub 2015 Mar 17. Review.
(26)Tomomi Endo, Jin Nakamura, Yuki Sato, Misako Asada, Ryo Yamada, Masayuki Takase, Koji Takaori, Akiko Oguchi, Taku Iguchi, Atsuko Y. Higashi, Tetsuya Ohbayashi, Tomoyuki Nakamura, Eri Muso, Takeshi Kimura, and Motoko Yanagita.
“Exploring the origin and limitations of kidney regeneration”
J Pathol. 2015 Jun;236(2):251-63. doi: 10.1002/path.4514. Epub 2015 Mar 4.
(25)Matthias Mack, Motoko Yanagita.
“Origin of myofibroblasts and cellular events triggering fibrosis”
Kidney Int. 2015 Feb;87(2):297-307. doi: 10.1038/ki.2014.287. Epub 2014 Aug 27. Review.
(24)Sachiko Yamada, Jin Nakamura, Misako Asada, Masayuki Takase, Taiji Matsusaka, Taku Iguchi, Ryo Yamada, Mari Tanaka, Atsuko Y Higashi, Tomohiko Okuda, Nariaki Asada, Atsushi Fukatsu, Hiroshi Kawachi, Daniel Graf, Eri Muso, Toru Kita, Takeshi Kimura, Ira Pastan, Aris N. Economides, and Motoko Yanagita.
“Twisted Gastrulation, a BMP antagonist, exacerbates podocyte injury”
PLoS One. 2014 Feb 25;9(2):e89135. doi: 10.1371/journal.pone.0089135. eCollection 2014.
(23)Mayumi Tomita, Misako Asada, Nariaki Asada, Jin Nakamura, Akiko Oguchi, Atsuko Y Higashi, Shuichiro Endo, Elizabeth Robertson, Takeshi Kimura, Toru Kita, Aris N. Economides, Jordan Kreidberg, and Motoko Yanagita.
“Bmp7 maintains undifferentiated kidney progenitor population and determines nephron numbers at birth”
PLoS One. 2013 Aug 26;8(8):e73554. doi: 10.1371/journal.pone.0073554. eCollection 2013.
(22)Koji Takaori, Motoko Yanagita.
“Kidney regeneration and stem cells”
Anat Rec (Hoboken). 2014 Jan;297(1):129-36. doi: 10.1002/ar.22801. Epub 2013 Dec 2. Review.
(21)Yuki Sato, Motoko Yanagita.
“Renal anemia: from incurable to curable”
Am J Physiol Renal Physiol. 2013 Nov 1;305(9):F1239-48. doi: 10.1152/ajprenal. 00233.2013. Epub 2013 Jul 24. Review.
(20)Motoko Yanagita
“Inhibitors/antagonists of the TGF-ß system in kidney fibrosis”
Nephrol Dial Transplant. 2012 Oct;27(10):3686-91. doi: 10.1093/ndt/gfs381. Review.
(19)Jin Nakamura, Motoko Yanagita.
“Bmp modulators in kidney disease.”
Discov Med. 2012 Jan;13(68):57-63. Review.
(18)Nariaki Asada, Masayuki Takase, Jin Nakamura, Akiko Oguchi, Misako Asada, Norio Suzuki, Ken-ichi Yamamura, Narihito Nagoshi, Shinsuke Shibata, Tata Nageswara Rao, Hans Joerg Fehling, Atsushi Fukatsu, Naoko Minegishi, Toru Kita, Takeshi Kimura, Hideyuki Okano, Masayuki Yamamoto, and Motoko Yanagita.
“Dysfunction of fibroblasts of extra-renal origin underlies renal fibrosis and renal anemia in mice”
J Clin Invest. 2011 Oct;121(10):3981-90. doi: 10.1172/JCI57301. Epub 2011 Sep 12.
(17)Mari Tanaka, Misako Asada, Atsuko Y Higashi, Jin Nakamura, Akiko Oguchi, Mayumi Tomita, Sachiko Yamada, Nariaki Asada, Masayuki Takase, Tomohiko Okuda, Hiroshi Kawachi, Aris N. Economides, Elizabeth Robertson, Satoru Takahashi, Takeshi Sakurai, Roel Goldschmeding, Eri Muso, Atsushi Fukatsu, Toru Kita, and Motoko Yanagita.
“Loss of the BMP antagonist, USAG-1 ameliorates disease in a mouse model of progressive hereditary kidney disease Alport syndrome”
J Clin Invest. 2010 Mar;120(3):768-77. doi: 10.1172/JCI39569. Epub 2010 Feb 8.
(16)Motoko Yanagita
“Antagonists of bone morphogenetic proteins in kidney diseases”
Curr Opin Investig Drugs. 2010 Mar;11(3):315-22. Review.
(15)Atsuko Y. Higashi, Tomokatsu Ikawa, Masamichi Muramatsu, Aris N. Economides, Akira Niwa, Tomohiko Okuda, Andrew J. Murphy, Jose Rojas, Toshio Heike, Tatsutoshi Nakahata, Hiroshi Kawamoto, Toru Kita, and Motoko Yanagita.
“Direct hematological toxicity and illegitimate chromosomal recombination caused by the systemic activation of CreERT2”
J Immunol. 2009 May 1;182(9):5633-40. doi: 10.4049/jimmunol.0802413.
(14)Motoko Yanagita
“BMP modulators regulate the function of BMP during body patterning and disease progression”
Biofactors. 2009 Mar-Apr;35(2):113-9. doi: 10.1002/biof.15. Review.
(13)Mari Tanaka, Shuichiro Endo, Tomohiko Okuda, Aris N. Economides, David M. Valenzuela, Andrew J. Murphy, Elizabeth Robertson, Takeshi Sakurai, Atsushi Fukatsu, George D. Yancopoulos, Toru Kita, Motoko Yanagita.
“Expression of BMP-7 and USAG-1 (a BMP antagonist) in kidney development and injury”
Kidney Int. 2008 Jan;73(2):181-91. DOI:10.1030/sj.ki.5002626 Epub 2007 Oct 17.
(12)Motoko Yanagita, Shuichiro Endo, Katsu Takahashi, Tomohiko Okuda, Fumihiro Sugiyama, Satoshi Kunita, Satoru Takahashi, Atsushi Fukatsu, Toru Kita, Takeshi Sakurai.
“USAG-1, a novel BMP antagonist abundantly expressed in the kidney, accelerates kidney injuries”
J Clin Invest. 2006 Jan;116(1):70-9. Epub 2005 Dec 8.
(11)Motoko Yanagita
“Modulator of bone morphogenetic protein activity in the progression of kidney diseases.”
Kidney Int. 2006 Sep;70(6):989-93. DOI:10.1038/sj.ki.5001731 Epub 2006 Jul 26.
(10)Motoko Yanagita
“BMP antagonists: their roles in development and involvement in pathophysiology”
Cytokine Growth Factor Rev. 2005 Jun;16(3):309-17. doi: 10.1016/j.cytogfr. 2005.02.007. Review.
(9)Kojiro Nagai, Takeshi Matsubara, Akira Mima, Eriko Sumi, Hiroshi Kanamori, Noriaki Iehara, Atsushi Fukatsu, Motoko Yanagita, Toru Nakano, Yoshikazu Ishimoto, Toru Kita, Toshio Doi, Hidenori Arai.
“Gas6 induces Akt/mTOR-mediated mesangial hypertrophy in diabetic nephropathy”
Kidney Int. 2005 Aug;68(2):552-61. DOI:10.1111/j.1523-1755.2005.00433.x
(8)Motoko Yanagita
“The role of the vitamin K-dependent growth factor Gas6 in glomerular pathophysiology”
Curr Opin Nephrol Hypertens. 2004 Jul;13(4):465-70. Review.
(7)Motoko Yanagita, Masako Oka, Tetsuro Watabe, Haruhisa Iguchi, Atsushi Niida, Satoru Takahashi, Tetsu Akiyama, Kohei Miyazono, Masashi Yanagisawa, Takeshi Sakurai.
“USAG-1: a bone morphogenetic protein antagonist abundantly expressed in the kidney”
Biochem Biophys Res Commun. 2004 Apr 2;316(2):490-500. DOI:10.1016/j.bbrc.2004.02.075
(6)Motoko Yanagita
“Gas6, warfarin, and kidney diseases”
Clin Exp Nephrol. 2004 Dec;8(4):304-9. DOI:10.1007/s10157-004-0305-z. Review.
(5)Kojiro Nagai, Hidenori Arai, Motoko Yanagita, Takeo Matsubara, Hirokazu Kanamori, Toru Nakano, Noriyuki Iehara, Atsushi Fukatsu, Toru Kita, Toshio Doi.
“Growth Arrest-specific Gene 6 is involved in glomerular hypertrophy in the early stage of diabetic nephropathy”
J Biol Chem. 2003 May 16;278(20):18229-34. DOI:10.174/jbc.M213266200 Epub 2003 Mar 17.
(4)Motoko Yanagita, Yoshikazu Ishimoto, Hidenori Arai, Kojiro Nagai, Tsuyoshi Ito, Toru Nakano, David Salant, Atsushi Fukatsu, Toshio Doi, Toru Kita.
“Essential role of Gas6 for glomerular injury in nephrotoxic nephritis”
J Clin Invest. 2002 Jul;110(2):239-46. DOI:10.1172/JCI14861
(3)Motoko Yanagita, Hidenori Arai, Toru Nakano, Kazumasa Ohashi, Kensaku Mizuno, Brian Varnum, Atsushi Fukatsu, Toshio Doi, Toru Kita.
“Gas6 induces mesangial cell proliferation via latent transcription factor STAT3”
J Biol Chem. 276(45);42364-42369, 2001. DOI:10.1074/jbc.M107488200 Epub 2001 Sep 6.
(2)Motoko Yanagita, Hidenori Arai, Kenji Ishii, Toru Nakano, Kazumasa Ohashi, Kensaku Mizuno, Brian Varnum, Atsushi Fukatsu, Toshio Doi, Toru Kita.
“Gas6 regulates mesangial cell proliferation through Axl in experimental glomerulonephritis”
Am J Pathol. 2011 Apr; 158;1423-32, 2001. DOI:10.1016/S0002-9440(10)64093-X
(1)Motoko Yanagita, Kenji Ishii, Harunobu Ozaki, Hidenori Arai, Kazumasa Ohashi, Kensaku Mizuno, Toru Nakano, Toru Kita and Toshio Doi.
“Mechanism of inhibitory effect of warfarin on mesangial cell proliferation”
J Am Soc Nephrol. 10;2503-9, 1999.
柳田研究室のこれまでの業績(著書)
“Heterogeneity of Fibroblasts in Healthy and Diseased Kidneys“
Bertoncelj, M. F. , Lakota, K. , editors.
Fibroblasts – Advances in Inflammation, Autoimmunity and Cancer. London: IntechOpen; 2021.
Available from: https://www.intechopen.com/chapters/77932 doi: 10.5772/intechopen.99492
研究グループの紹介